Digitale therapeutica (DTx) winnen snel aan belang en bij Lux blijven we betrokkenheid bij DTx-bedrijven aanbevelen. Wie zich echter inlaat met bedrijven die zich bezighouden met digitale therapeutica, moet op zijn hoede zijn dat hij niet in de val trapt van een hype met klinische gegevens.
Om door deze ruimte te navigeren, zijn er vier hindernissen waar organisaties zich bewust van moeten zijn als het gaat om de waarde van een digitaal therapeutisch bedrijf: klinische validatie, wettelijke goedkeuring, vergoeding door betalers en acceptatie door artsen.
Klinische validatie
Bedrijven verifiëren de werkzaamheid bij de behandeling van een aandoening door klinische resultaten te vergelijken met drie verschillende maatstaven. Ze kunnen hun product vergelijken met geen behandeling, met een minimale zorgstandaard of met de "gouden standaard" van behandeling. Cognoa, een bedrijf dat een diagnose en een behandeling voor autisme ontwikkelt, vergelijkt zichzelf bijvoorbeeld met traditionele persoonlijke therapiesessies met een autismespecialist. Deze vergelijking is met de huidige "gouden standaard" in de autismezorg.
Meestal hebben bedrijven weinig problemen met het verkrijgen van klinische validatie voor hun product, met name validatie die voorafgaat aan door de regelgevende instantie vereiste validatiestudies. Klinische validatie is belangrijk, maar vaak overschaduwt de hype rond deze bedrijven de werkelijke waarde van een bedrijf. Klinische validatie is in feite het absolute minimum om in zee te gaan met een DTx-bedrijf. Eén manier om door de hype rond klinische gegevens heen te prikken, is te erkennen dat een goed DTx-bedrijf gevalideerd moet worden door een vergelijking met de gouden standaard voor behandelingen in het veld.

Reglementaire goedkeuring
De Amerikaanse FDA heeft twee wegen voor een medisch product om op de markt te komen: goedkeuring en toelating. Goedkeuring door de FDA vereist dat het product voldoende lijkt op bestaande producten op de markt, zodat het geen risico vormt voor consumenten. Goedkeuring door de FDA vereist daarentegen dat producten strenge klinische tests ondergaan op het gebied van veiligheid en werkzaamheid. Met deze trajecten proberen veel therapeutische bedrijven samen te werken met farmaceutische bedrijven om gebruik te maken van hun ervaring en kennis van regelgevende instanties.
Met de komst van het therapeutisch gerichte software-precertificatie goedkeuringsprogramma staat DTx echter voor een nieuw FDA-goedkeuringstraject, waarbij de farmaceutische industrie weinig ervaring heeft en DTx-bedrijven hun eigen weg moeten zoeken. Startups die zich in een meer volwassen (voor startups) stadium bevonden, dienden een aanvraag in om deel uit te maken van het pilot-precertificeringsprogramma van de FDA, en degenen die een aanvraag indienden, slaagden erin goedkeuring te krijgen. Over het algemeen slagen de meeste DTx-bedrijven erin om goedkeuring te krijgen door middel van partnerschappen en door deel te nemen aan de ontwikkeling van het wettelijke precertificeringspad.
Betaler Vergoeding
Meer ontwikkelde DTx-bedrijven komen tot de ontdekking dat acceptatie en terugbetaling door de betaler de sleutel is tot levensvatbaarheid op de markt en dat er al in de ontwikkelingsfase voorbereidingen moeten worden getroffen om de steun van de betaler te verwerven. Meestal werken bedrijven samen met farmaceutische bedrijven om gebruik te maken van de traditionele terugbetalings- en distributiepaden van verzekeringen, zoals Pear Therapeutics, dat profiteert van de samenwerking met Sandoz. Andere bedrijven, zoals Better Therapeutics, zijn echter op zoek naar alternatieve terugbetalingstrajecten voor de betaler, waarbij ze in plaats daarvan op zoek gaan naar plannen voor apothekersvoordeelbeheer of directe distributie naar patiënten via werkgevers als aanvullende voordeelprogramma's.
Adoptie door artsen
Nu de oudste DTx'en volwassen beginnen te worden, is de acceptatie door artsen de laatste hindernis voor de acceptatie door consumenten. Er zijn drie belangrijke benaderingen om artsen te overtuigen. Pear Therapeutics gebruikt het farmaceutische model en maakt gebruik van farmaceutische distributiepartnerschappen om artsen bewust te maken van het product en bereid te maken om het voor te schrijven. Better Therapeutics, dat een product voor slapeloosheid ontwikkelt, werkt samen met een apothekersvoordeelplan dat specifiek een digitale apotheek aanbiedt - waarbij de door de voordelen gedekte producten op één platform worden samengebracht dat artsen kunnen gebruiken bij het doen van therapeutische aanbevelingen. Kaia Health volgt een minder traditionele aanpak - het bedrijf richt zich met een marketingcampagne op artsen, maar de app staat in de App Store en biedt drie abonnementspakketten voor patiënten.
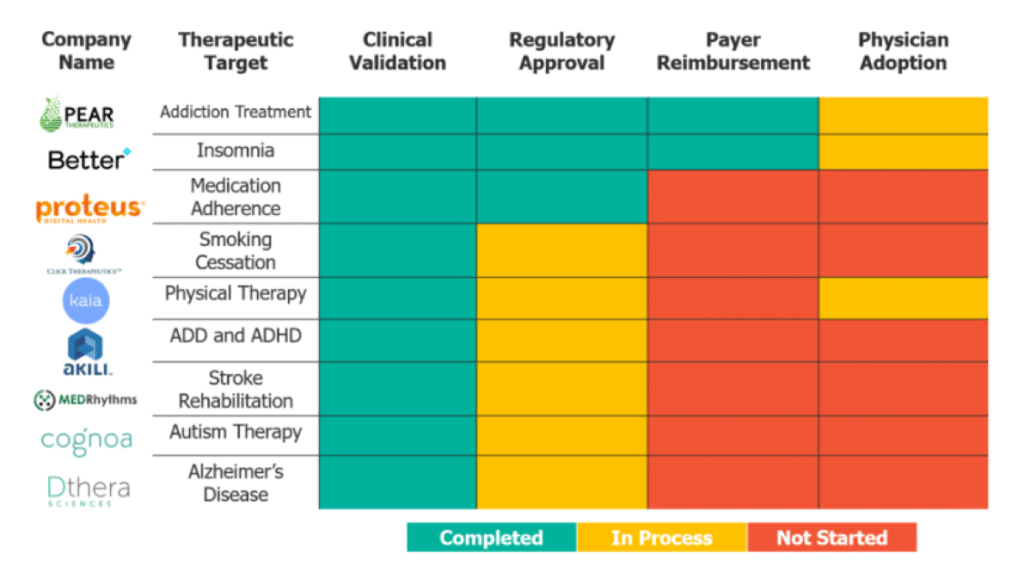
Hoe ziet het DTx-landschap er nu uit? De bovenstaande figuur laat zien waar negen van de meest volwassen DTx-bedrijven staan als het gaat om het overwinnen van deze vier hindernissen. Alle bedrijven hebben klinische validatie van hun product verkregen en als ze nog geen goedkeuring van de regelgevende instanties hebben gekregen, zijn ze daar wel mee bezig. Van de negen hebben er slechts twee het betalerslandschap doorkruist en geen van de bedrijven heeft een consistente acceptatie door artsen laten zien.
Nu de eerste twee hordes (klinische validatie en wettelijke goedkeuring) eenvoudiger te nemen zijn, zijn er twee dingen waar een DTx-bedrijf naar moet zoeken: een strategie om patiënten te bereiken en partnerschappen. Een gerenommeerd DTx-bedrijf zal een strategie hebben om patiënten te bereiken, waarbij wordt gekeken of het therapeuticum curatief is, zoals in het geval van Better Therapeutics, of bedoeld voor chronische zorg. Curatieve therapeutica neigen naar een traditioneel verzekerings- en artsendistributiemodel, terwijl chronische zorg meer neigt naar apotheekvoordelen. Een goed DTx-bedrijf zal waarschijnlijk ten minste één samenwerkingsverband hebben met de farmaceutische industrie om te helpen bij het regelgevingsproces, de terugbetaling door betalers of de acceptatie door artsen.